Das Zeitalter der Industrie
Kohlenstoffkreislauf & Klimawandel
Auf der Erde gibt es etwa 75 Billiarden (= Millionen
Milliarden) Tonnen Kohlenstoff. 99,8 Prozent davon
befindet sich im Gestein, und davon wiederum fast alles im
Kalkstein. (Der vergleichsweise kleine Rest kommt in zwei Formen
vor: Zum einen als die fossilen Brennstoffe Kohle, Erdöl und Erdgas,
deren Vorkommen etwa 4.100 Milliarden Tonnen Kohlenstoff enthalten;
zum anderen als sogenanntes Kerogen. So nennt man fein verteiltes
organisches Material, das aufgrund seiner geringen Konzentration
nicht als Brennstoff nutzbar ist.) Im Vergleich zu den Mengen im
Gestein scheinen die Anteile im Wasser (38.000 Milliarden Tonnen =
0,05 Prozent des gesamten Vorkommens), im Boden (1.580 Milliarden
Tonnen = 0,002 Prozent des gesamten Vorkommens), in Lebewesen mit
etwa 800 Milliarden Tonnen und in der Luft mit etwa 820 Milliarden
Tonnen (jeweils etwa 0,001 Prozent des gesamten Vorkommens)
unbedeutend zu sein.
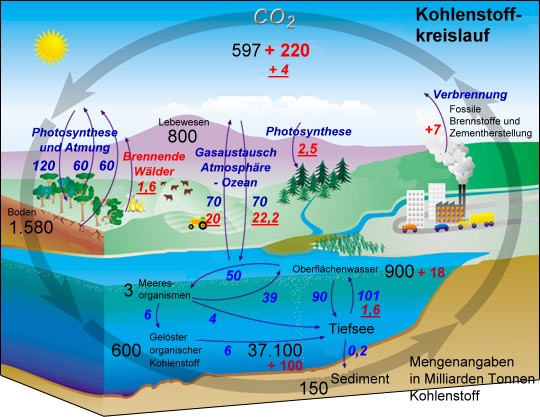
Der globale Kohlenstoffkreislauf.
Die Zahlen geben die Kohlenstoffspeicher (schwarz), die
jährlichen Flüsse zwischen den Speichern vor der industriellen
Revolution (blau) sowie die seit Beginn der industriellen Revolution
durch menschliche Aktivitäten dazugekommenen Menge (rot) und die
heute jedes Jahr vom Menschen verursachten zusätzlichen
Kohlenstoffflüsse (rot und unterstrichen) an. Zur Erläuterung siehe
den folgenden Text. (Das Hintergrundbild stammt von der NASA,
http://earthobservatory.nasa.gov/Features/CarbonCycle/carbon_cycle4.php)
Sie sind es nicht, wie alleine die Diskussion um den Klimawandel
zeigt, der im Wesentlichen von einer Änderung der
Kohlendioxidkonzentration in der Luft ausgelöst wird (>> mehr).
Kohlenstoff spielt eine zentrale Rolle auf der Erde, da er aus
chemischer Sicht ungeheuer vielseitig ist: Die gesamte organische
Chemie beschäftigt sich mit den Eigenschaften des Kohlenstoffs und
seiner Verbindungen - das sind mehr Chemiker, als sich für
irgendeinen anderen Stoff interessieren. Leben auf der Erde ist ohne
Kohlenstoff unvorstellbar; früher galt Kohlenstoff sogar als
Kennzeichen des Lebens (daher auch „organische“ Chemie). Die
Fotosynthese, die Sonnenlicht in energiereiche Kohlenstoffformen
umwandelt, ist die wohl wichtigste chemische Reaktion auf der Erde.
Kohlenstoff kommt auf der Erde in zwei
unterschiedlichen Formen vor: als oxidierter, anorganischer
Kohlenstoff oder als organischer Kohlenstoff
(siehe Kasten). Anorganischer Kohlenstoff ist chemisch stabiler, zu
dieser Gruppe gehört das Kohlendioxid in der Luft oder das
Kalziumkarbonat in den Weltmeeren. Organischer Kohlenstoff ist
chemisch reaktiver, was unter anderem seine Rolle für das Leben auf
der Erde ausmacht. Zu dieser Gruppe gehören die Kohlenwasserstoffe
(Verbindungen aus Kohlenstoff und Wasserstoff, wie die fossilen
Brennstoffe Erdöl und Erdgas, aber auch Fett) und die Kohlenhydrate
(Verbindungen aus Kohlenstoff, Wasserstoff und Sauerstoff, etwa
Zucker).
Oxidiert
und reduziert… Was war das noch mal?
Oxidieren bedeutet nach Duden: sich mit Sauerstoff verbinden (kann
man sich leicht merken, wenn man Griechisch kann: dort heißt
Sauerstoff Oxygenium). Bei dieser Verbindung nimmt jedes
Sauerstoffatom zwei Elektronen von seinem Reaktionspartner auf und
wird zum Oxid. Wenn Eisen rostet, ist dies eine Reaktion mit
Sauerstoff, Rost besteht aus der Sicht des Chemikers aus
Eisenoxiden. Da jedes Elektron eine negative Ladung trägt (-1
geschrieben), „fehlen“ dem Kohlenstoff im Kohlendioxid, der
Verbindung von einem Atom Kohlenstoff mit zwei Atomen Sauerstoff (CO2),
vier Elektronen, seine Ladung beträgt +4. Der Kohlenstoff liegt im
oxidierten Zustand vor, hat also Elektronen abgegeben.
Im Gegensatz zum Sauerstoff überlässt der Wasserstoff
bei Reaktionen seinen Reaktionspartnern gerne ein Elektron. Im
Methan, die Verbindung eines Kohlenstoffatoms mit vier
Wasserstoffatomen (CH4), beträgt die Ladung des
Kohlenstoffs daher -4; der Kohlenstoff ist reduziert. Bei den
Kohlenhydraten (CH2O) liegt der Kohlenstoff neutral vor,
hier erhält der Sauerstoff seine Elektronen vom Wasserstoff, die
Ladung des Kohlenstoffs beträgt 0. Da er nicht oxidiert ist, werden
auch die Kohlenhydrate zum organischen Kohlenstoff gerechnet.
(Mehr über Redoxreaktionen.)
Kohlenstoffaustausch mit Lebewesen und Boden
Die Fotosynthese ist der Prozess, der
anorganischen Kohlenstoff (Kohlendioxid) in organischen Kohlenstoff
(Zucker) umwandeln kann (>> mehr).
Der umgekehrte Prozess wird Atmung genannt, dabei
werden Zucker zur Energiegewinnung abgebaut, wir atmen Kohlendioxid
aus. Der meiste organische Kohlenstoff in Lebewesen
wird auf diese Art und Weise wieder in anorganisches Kohlendioxid
umgewandelt. Aber ein Teil bleibt dauerhaft in organischen
Strukturen eingeschlossen. Dies kann in Torfmooren der Fall sein,
wenn Pflanzenmaterial auf Grund von Sauerstoffmangel nicht zersetzt
wird, vor allem aber, wenn organisches Material in das Sediment der
Tiefsee absinkt und über lange Zeiträume zu Sedimentgestein wird
(>> mehr).
Über Fotosynthese und Atmung steht das Kohlendioxid in der Luft
also mit dem organischen Kohlenstoff in Lebewesen in Verbindung.
Ähnliches gilt für den Kohlenstoff im Boden: Er
besteht zum größten Teil aus totem Pflanzenmaterial; durch den Abbau
wird er in Kohlendioxid umgewandelt und gelangt so wieder in die
Luft. Der Kohlenstoffgehalt von Böden kann je nach Boden und Klima
sehr unterschiedlich sein; in Wüsten gibt es kaum Kohlenstoff im
Boden, in sommergrünen Wäldern relativ viel (in tropischem Klima
eher weniger, da dort die Abbauvorgänge viel schneller sind).
Findet der Abbau unter Sauerstoffmangel statt, etwa in der Tiefsee
oder in Sümpfen, reagiert organischer Kohlenstoff mit Sulfat-Ionen,
dabei entsteht Schwefelwasserstoff (H2S). Sind auch keine
Sulfat-Ionen (mehr) vorhanden, findet eine Gärung statt, bei der Methan
(CH4) entsteht. In Süßwasser, wo Sulfat-Ionen seltener
sind, geschieht dies schneller, Methan wird daher auch „Sumpfgas“
genannt. Methan ist ein hochwirksames Treibhausgas; in der
Atmosphäre wird es unter Einwirkung von Sonnenlicht langsam zu
Kohlendioxid oxidiert; seine mittlere Lebensdauer in der Atmosphäre
beträgt 8,4 Jahre.
Kohlenstoffaustausch mit dem Meer
Im Meerwasser liegt Kohlenstoff in etwa 50fach
größerer Menge als in der Luft vor, vor allem als gelöster
anorganischer Kohlenstoff: in Form von Kohlendioxid,
Kohlensäure (H2CO3), Karbonat- (CO32-)
und Bikarbonat-Ionen (HCO3-). Daneben gibt es
gelösten organischen Kohlenstoff, der ähnlich wie
im Boden aus toten Lebewesen besteht, und den organischen
Kohlenstoff in Meeresorganismen. Der Konzentration des
gelösten anorganischen Kohlenstoffs im Meerwasser und des
Kohlendioxids der Luft stehen in einem Gleichgewicht. Die Anpassung
geschieht jedoch relativ langsam, da das Meerwasser nur an seiner
Oberfläche in direktem Kontakt mit der Luft steht; bei Veränderungen
der Konzentration kann es Hunderte von Jahren dauern, bis sich ein
neues Gleichgewicht einstellt (das ist auch der Grund dafür, dass
das Meerwasser weniger von den Emissionen aus fossilen Brennstoffen
aufgenommen hat als die Atmosphäre, obwohl es der bei weitem größere
Kohlenstoffspeicher ist). Erdgeschichtlich ist dieser Austausch von
großer Bedeutung, so werden die Schwankungen des
Kohlendioxid-Gehalts der Luft während der Kalt- und Warmzeiten der
>>
Eiszeit wesentlich von den Ozeanen verursacht.
Kohlenstoffaustausch mit dem Gestein
Auf lange Sicht nimmt auch der Kohlenstoffvorrat im
Gestein am Kohlenstoffkreislauf teil. Wenn sich
Wasserdampf in der Erdatmosphäre mit Kohlendioxid verbindet,
entsteht Kohlensäure und damit leicht kohlensäurehaltiges
Regenwasser. Trifft dieses auf Silikatgestein, reagiert es mit
diesem und es entstehen Bikarbonat-Ionen, Siliziumdioxid und ein -
je nach Gestein - ein Kalzium- oder Magnesium-Ion. Am Beispiel des
Silikat-Minerals Wollastonit sieht das so aus:
CaSiO3 + 2 CO2 + H2O ->
Ca2+ + 2 HCO3- + SiO2
Kalzium und Bikarbonat reagieren zu Kalziumkarbonat:
Ca2+ + 2 HCO3- -> CaCO3
+ CO2 + H2O
In der Summe wurde also ein Kohlendioxid-Molekül im Kalziumkarbonat
gebunden:
CaSiO3 + CO2 -> CaCO3 +
SiO2
Kalziumkarbonat sinkt im Ozean als Sediment auf den Boden und wird
mit der Zeit und unter dem Druck der Wassersäule und weiterer
Sedimente schließlich zu Sedimentgestein - aus dem ursprünglichen
Silikatgestein ist jetzt Kalkgestein geworden. Umgekehrt wird im
Erdinneren unter Hitzeeinwirkung Kohlendioxid aus Kalkstein
freigesetzt – dieses Kohlendioxid kann bei Vulkanausbrüchen oder in
heißen Quellen am Meeresgrund wieder in den Kreislauf gelangen. Die
Mengen dieser Vorgänge sind vergleichsweise klein und liegen bei 100
Millionen Tonnen pro Jahr. In geologischen Zeiträumen tragen sie
aber zur Stabilisierung des Erdklimas bei (siehe auch >> hier):
Wenn das Klima wärmer wird, fällt mehr Regen, die Verwitterung nimmt
zu und bindet mehr von dem Treibhausgas Kohlendioxid – es wird
wieder kälter. Ist es dagegen kälter, ist die Freisetzung von
Kohlendioxid größer als die Verwitterung, die Konzentration nimmt zu
und es wird wärmer. Damit bildet die Silikatverwitterung einen
Regelkreis, der die Kohlendioxidkonzentration immer in eine Richtung
lenkt, bei der die Verwitterung genau der Freisetzung entspricht.
Für das Leben auf der Erde ist diese Kohlendioxidfreisetzung von
zentraler Bedeutung - ohne sie wäre der Kohlenstoff, der zentrale
Baustoff des >> Lebens,
längst vollständig im Gestein gebunden. Die Hitze im Erdinneren
gehört damit zu den Voraussetzungen für Leben auf der Erde (>>
mehr). Dieses Thermostat ist jedoch
sehr langsam, so dass es Konzentrationsschwankungen durch schnelle
Veränderungen, etwa im Zusammenhang mit Eiszeiten oder heute durch
die Verbrennung fossiler Brennstoffe, nicht ausgleichen kann.
Der Einfluss des Menschen
In jüngster Zeit hat der Mensch massiv in diesen Kreislauf
eingegriffen (die roten Zahlen in der >
Abbildung), indem fossile Brennstoffe verbrannt und Wälder zur
Landgewinnung abgebrannt wurden. Dabei gelangte der in ihnen
gebundene Kohlenstoff in die Luft, vor allem in Form des Treibhausgases
Kohlendioxid (>> mehr).
Der Kohlenstoffgehalt in der Luft hat sich dadurch von
vorindustriellen 597 Milliarden Tonnen auf die heutigen 820
Milliarden Tonnen erhöht (oder bekannter, da regelmäßig in den
Zeitungen zu lesen: die Konzentration an Kohlendioxid von 280 ppm
auf heute 390 ppm); der damit verbundene Klimawandel macht den
Kohlenstoffkreislauf heute zu einem Schwerpunkt der Forschung am
Ökosystem Erde.
Freisetzung von Kohlendioxid
Das vom Menschen in die Atmosphäre eingebrachte Kohlendioxid geht
vor allem auf zwei große Quellen zurück. Die erste war die Brandrodung
von Wäldern. In einem Wald ist (in Form von Holz) mehr
Kohlenstoff gespeichert als auf einem gepflügten Acker; wenn Wald
abgebrannt wird, um Ackerland zu gewinnen, wird dieser freigesetzt.
Die Gewinnung von Ackerland begann bald nach der Erfindung der
Landwirtschaft (>> mehr),
nahm aber mit den technischen Möglichkeiten der Industriellen
Revolution noch einmal erheblich zu (>>
mehr), und ist bis heute vor allem in den tropischen
Regenwäldern nicht beendet. Auf diese Weise gelangen zur Zeit etwa
1,6 Milliarden Tonnen Kohlenstoff (oder knapp 6 Milliarden Tonnen
Kohlendioxid) in die Atmosphäre.
Die andere, heute noch bedeutendere Quelle ist die Verbrennung
fossiler Brennstoffe, deren Beginn auch den Anfang der
Industriellen Revolution bedeutete (>>
mehr). Dadurch wurden im Jahr 2006 27,3 Milliarden Tonnen
Kohlendioxid (oder knapp 7,5 Milliarden Tonnen Kohlenstoff) in die
Atmosphäre eingebracht. (Die Angabe in der >
Abbildung ist der Durchschnittswert der Jahre 2000 bis 2005 -
allen Bekenntnissen zum Klimaschutz zum Trotz nimmt der Ausstoß von
Kohlendioxid weiterhin zu; im Jahr 2010 war er so hoch wie noch nie
zuvor in der Geschichte der Menschheit.)
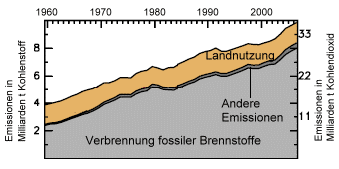
Entwicklung der
Kohlendioxidemissionen in die Atmosphäre
von 1959 bis 2006 (“Andere Emissionen” umfassen vor allem
die Zementproduktion). Abb. nach >> Canadell
et al. 2007.
Kohlenstoffsenken
Von dieser Gesamtmenge verbleibt nur ein Teil dauerhaft in der
Atmosphäre, zur Zeit etwa 15 Milliarden Tonnen Kohlendioxid pro Jahr
– diese Menge kennt man relativ genau, da sie über die steigende
Kohlendioxid-Konzentration in der Atmosphäre errechnet werden kann.
Die „fehlende“ Menge, also die Differenz aus freigesetztem
Kohlendioxid und in der Atmosphäre verbleibendem Kohlendioxid, wird
von den Kohlenstoffsenken aufgenommen –
Ökosysteme, deren Kohlenstoffgehalt bei steigendem Angebot in der
Luft steigt.
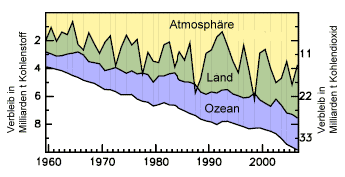
Verbleib des Kohlendioxids
von 1959 bis 2006. Die Aufnahme
in den Kohlenstoffsenken schwankt von Jahr zu Jahr; mit
steigenden Emissionen verbleibt ein zunehmender Anteil
in der Atmosphäre. Abb. nach >> Canadell
et al. 2007.
Landökosysteme können zur Kohlenstoffsenke werden,
da durch den Klimawandel in höheren Breiten die Wachstumsbedingungen
für Pflanzen verbessert und die Wachstumssaison verlängert wird, und
weil Pflanzen bei steigendem Kohlendioxidgehalt besser wachsen
können („Kohlendioxiddüngung“) – aber nur, wenn eine Reihe anderer
Bedingungen stimmen. So darf es etwa nicht zu trocken sein, und es
dürfen auch keine Nährstoffe fehlen. Andererseits nimmt etwa der
Abbau organischen Materials im Boden mit steigenden Temperaturen zu.
Welcher Effekt wie stark ist, ist nicht einfach zu ermitteln. Der
größte Anteil des Kohlenstoffs findet sich ja in den Böden, ist aber
dort sehr ungleichmäßig verteilt – daher stellt sich immer die Frage
nach der Aussagekraft der einzelnen Untersuchungen.
Die einfachste Abschätzung des von den Landökosystemen gebundenen
Kohlenstoffs ist natürlich, einfach die Menge zu ermitteln, die im
Ozean, der anderen großen Senke, bleibt und so indirekt auf die
Aufnahme an Land zu schließen. Eine andere Methode besteht darin,
das Kohlenstoff-/Sauerstoff-Verhältnis auszuwerten: Bei der Aufnahme
in Landökosystemen mit der Fotosynthese wird ja Sauerstoff
produziert - im Meer dagegen kaum, siehe unten. So wird die
Netto-Aufnahme an Land heute auf etwa 900 Millionen Tonnen
Kohlenstoff pro Jahr berechnet. Um den Wissenstand über die
Verteilung und die Mechanismen dieser Aufnahme zu verbessern, sind
zur Zeit große Forschungsprogramme in Gang (in Europa etwa ein
Programm namens CarboEurope, www.carboeurope.org).
Die Aufnahme von Kohlenstoff im Ozean ist etwas
leichter zu ermitteln, da die Prozesse überschaubarer sind. Etwas
leichter sollte aber nicht mit leicht verwechselt werden, denn auch
der Ozean ist ein komplexes System. So ist etwa das
Oberflächenwasser durch Dichteunterschiede relativ stabil vom
Tiefenwasser abgetrennt, eine Durchmischung findet vor allem an den
Polen statt, wo das Oberflächenwasser so weit abkühlt, dass diese
möglich wird (>> mehr).
Gase aus der Atmosphäre werden zunächst vom Oberflächenwasser
aufgenommen, das bis in eine Tiefe von etwa 100 Meter vom Wind
durchmischt wird. In die Tiefe gelangen sie erst, wenn das
Oberflächenwasser dorthin absinkt.
Wenn Kohlendioxid in Wasser gelangt, bildet sich Kohlensäure (H2CO3).
In der Lösung spaltet diese Wasserstoff ab, so dass ein
Bikarbonat-Ion (HCO3-) entsteht. Dieses
wiederum steht in einem Gleichgewicht mit Karbonat-Ionen (CO32-).
Das Verhältnis kann etwas vereinfacht so dargestellt werden:
CO2 + CO32- + H20
<-> 2HCO3-
Wenn sich nun die Menge an Kohlendioxid erhöht, reagiert dieses mit
Karbonat-Ionen und bildet Bikarbonat-Ionen. Da Karbonat-Ionen in
größerer Menge im Meerwasser vorhanden sind, kann das Meerwasser
über diesen Weg Kohlendioxid aufnehmen, wodurch es eine hohe
Speicherkapazität für Kohlendioxid hat. Bis hierhin wäre die
Aufnahme von Kohlendioxid einfach zu berechnen, eine unbekannte
Größe wäre nur der Austausch zwischen Oberflächen- und Tiefenwasser.
Aber das Ökosystem Meer ist komplexer: Karbonat-Ionen werden von
Korallen und anderen Meeresorganismen gebraucht, um Kalkstrukturen
und –schalen zu bilden. Diese bestehen aus Kalziumkarbonat (CaCO3),
gebildet aus Kalzium-Ionen und Karbonat-Ionen:
Ca2+ + CO32- -> CaCO3.
Beim Absterben der Organismen sinken diese zu Boden, dadurch wird
Kohlenstoff aus dem Kreislauf entfernt; die Ozeanforscher nennen
diesen Vorgang die „Karbonat-Pumpe“. (Zunehmender
Eintrag von Kohlendioxid führt dazu, dass immer mehr Karbonat-Ionen
zu Bikarbonat-Ionen umgewandelt werden, wodurch den Organismen der
Baustoff für ihre Kalkstrukturen abhanden kommt: Daher leiden diese
Organismen unter dem Kohlendioxid-Eintrag, der wegen der
Kohlensäure-Bildung auch als >> Versauerung
der Meere bekannt ist.)
Ein anderer Weg, Kohlendioxid zu binden, sind kleine, im Wasser
schwebende Pflanzen, das Phytoplankton: Sie nehmen Kohlendioxid über
die Fotosynthese auf, und nach ihrem Tod gelangt ein Teil dieses
Kohlenstoffs durch Absinken in die Tiefsee; dies ist die „biologische
Pumpe“. Die Menge des vom Ozean aufgenommenen
Kohlenstoffs konnte auf verschiedenen Wegen berechnet werden. Einer
besteht in der Messung der Konzentration der relevanten Substanzen
wie Karbonat- und Bikarbonat-Ionen; ein anderer sind
Modellrechnungen unter Einbeziehung des Austausches von Oberflächen-
und Tiefenwasser, der wiederum durch Nachverfolgen seltener
Chemikalien oder von radioaktiven Stoffen im Meerwasser untersucht
wird (so haben Umweltverschmutzung und Atomwaffenversuche auch ihre
nützliche Seite). Das Ergebnis: Bisher hat der Ozean etwa 155
Milliarden Tonnen Kohlenstoff aufgenommen, mehr als ein Drittel der
gesamten vom Menschen verursachten Emissionen. Jedes Jahr nehmen die
Meere netto weitere 2,2 Milliarden Tonnen Kohlenstoff auf.
Bei fortgesetztem Klimawandel könnte dieser Beitrag aber
zurückgehen: Zum einen erwärmt sich das Oberflächenwasser, warmes
Wasser kann aber weniger Kohlendioxid lösen. Zum anderen werden
dabei Karbonat-Ionen verbraucht, so dass die „Karbonat-Pumpe“ an
Wirkung verlieren könnte. Und drittens erwärmt sich das Meerwasser
an den Polen am stärksten, was den Austausch von Oberflächen- und
Tiefenwasser behindern könnte. Diese Annahme wird auch dadurch
unterstützt, dass in den letzten Jahren erkannt wurde, dass die
Schwankungen der Kohlendioxid-Konzentration in der Erdatmosphäre
während der Eiszeiten entscheidend von der Kohlendioxid-Aufnahme und
-Freisetzung der Weltmeere verursacht worden sind (siehe >> Die Eiszeiten).
Auch die Kohlendioxid-Aufnahme in den Landökosystemen könnte durch
den Klimawandel, unter anderem durch Wassermangel, beeinträchtigt
werden. Die meisten Klimaforscher gehen daher für die Zukunft von
einer sinkenden Aufnahme durch die Kohlenstoffsenken aus.
Freisetzung von Methan
Durch menschliches Handeln wird das Treibhausgas Methan in größeren
Mengen freigesetzt, als dies natürliche Quellen wie Sümpfe, Ozean
und andere tun. Methan wird bei der Öl- und Gasförderung
freigesetzt, beim Vergären von Abfällen in Mülldeponien
(„Deponiegas“), durch den Reisanbau und die Zucht von Wiederkäuern.
Damit trägt Methan mit etwa 20 Prozent zum Klimawandel bei; da es im
Laufe der Zeit in der Atmosphäre zu Kohlendioxid oxidiert, spielt es
im Kohlenstoffkreislauf keine eigene Rolle.
Ein Blick in die Zukunft
In Zeiträumen von Jahrhunderten werden etwa drei Viertel des
freigesetzten Kohlendioxids vom Meerwasser aufgenommen. Je nachdem,
wie viel Kohlendioxid die Menschheit insgesamt freisetzt, würde eine
massive Versauerung des Meerwassers dazu führen, dass Wasser mit den
Sedimenten am Meeresgrund reagiert, gelöstes Kalziumkarbonat würde
über Jahrtausende die Versauerung wieder ausgleichen. Das in der
Luft verbleibende Viertel wird in Jahrhunderttausenden durch die
Verwitterung von Gestein gebunden. Die Natur wäre – nach sicherlich
schweren Verlusten – geheilt.