Der Aufbau der Materie
Hintergrundinformation
1 Der Aufbau des Atoms
Alle Materie besteht aus Atomen. Die ersten, die dieses erkannten,
waren der in der Tradition der Philosophen
von Milet stehende Leukipp und sein Schüler Demokrit im 5.
Jahrhundert vor unserer Zeit. Ihre Schriften sind verschollen, wir
kennen sie nur aus Zusammenfassungen und Zitaten anderer Autoren.
Schon Anaximander hatte vermutet, dass die Welt aus einem
"Grundstoff" besteht, der die Elemente der Welt bildet. Demokrit
erkannte nun, dass Räder verschleißen, da von ihnen winzige Teilchen
Holz abgerieben werden, und dass nasse Wäsche trocknet, weil das
Wasser sich in einzelnen Teilchen nach und nach verflüchtete. Er
schloss aber, dass die Teilchen zwar winzig seien, aber nicht
unendlich geteilt werden könnten: dann würde man bei Punkten ohne
Ausdehnung enden; und Punkte ohne Ausdehnung könnten keine Materie,
die eine Ausdehnung hat, bilden – viele Male null bleibt null. Also
könne man Materie nicht endlos, sondern nur bis zu einem unteilbaren
kleinsten Teilchen teilen. Dieses nannte er átomos,
"unteilbar"; das wurde zur Wurzel des heutigen Wortes Atom.
Die Vielfalt der Welt sei alleine aus der Bewegung und der
Kombination der Atome erklärbar, so wie das Alphabet mit wenigen
Buchstaben Komödien und Tragödien, lustige Erzählungen und große
Epen hervorbringen konnte (710).
Demokrits Idee setzte sich zunächst nicht durch; die antike Welt
glaubte mit Empedokles und Aristoteles, dass die Welt aus den vier
Elementen Feuer, Erde, Luft und Wasser bestünde (Aristoteles
"widerlegte" Demokrits Idee mit der Anmerkung, dass in dem Fall ja
nichts das Auseinanderfallen von Menschen und anderen Dingen in ihre
einzelnen Atome verhindern würde).
Aber als zu Beginn des 19. Jahrhunderts die Chemiker feststellten,
dass bei der Zerlegung chemischer Stoffe immer nur wenige Stoffe
übrigblieben, die sich nicht weiter zerlegen ließen (die Elemente)
und bei chemischen Reaktionen immer konstante Mengenverhältnisse
vorkamen, belebte der englische Naturforscher John Dalton
Demokrits Idee wieder und entwickelte sie weiter: In seinem 1808
erschienenen Werk "A New System of Chemical Philosophy" schrieb er,
die Materie bestehe aus unteilbaren Atomen (soweit folgte er
Demokrit), und es gäbe genau so viele verschiedenartige Atome, wie
es Elemente gibt. Die Atome eines Elements seien
untereinander gleich, die verschiedener Elemente unterschieden sich
durch Größe und Masse (hier entwickelte der Demokrits Idee weiter).
Verbindungen entstünden durch die Vereinigung der
Atome; bei chemischen Reaktionen würden die Atome
neu angeordnet (was erklärte, warum dabei immer nur bestimmte
Massenverhältnisse der Elemente auftraten). Die Idee des Atoms blieb
aber umstritten, unter anderem, weil man sie nicht sehen konnte.
Noch 1897 lehnte etwa der Physiker Ernst Mach die Atomtheorie ab.
Nachgewiesen wurde ihre Existenz endgültig im Jahr 1905 durch Albert
Einstein (730):
Er zeigte nämlich, dass man sie doch sehen konnte, mitunter gar mit
bloßem Auge. Einstein vermutete, dass die zuckenden Bewegungen von
Staubkörnern oder Pollen, die in Lichtstrahlen in ansonsten dunklen
Zimmern erkennbar sind und die auch in Flüssigkeiten auftreten (die
von dem Botaniker Robert Brown 1827 erkannte "Brownsche Bewegung"),
durch ihren Zusammenstoß mit Luft- bzw. Flüssigkeitsmolekülen
verursacht wird. Einstein entwickelte eine Methode, aus dieser
Bewegung die Molekülgröße zu bestimmen; und die war so klein, dass
deutlich wurde, dass die Atome nicht nur eine praktische chemische
Konvention, sondern eine physikalische Realität waren.
Zu diesem Zeitpunkt war jedoch schon klar, dass die Atome doch
nicht unteilbar waren: 1897 hatte der englische Physiker Joseph John
Thomson entdeckt, dass die Kathodenstrahlung aus geladenen Teilchen
(siehe rechts) besteht, die aus den Atomen kommen (die damit
eigentlich nicht mehr so heißen sollten). Thomsons Teilchen wurde Elektron
genannt. (Thomson erklärte auch den elektrischen Strom als Fluss
von Elektronen und bekam dafür 1906 den Nobelpreis.)
1911 entdeckte der neuseeländische Physiker Ernest
Rutherford, dass das Atom aus Kern und Hülle
zusammengesetzt ist (734),
und entwickelte ein Atommodell, bei dem die positiven Ladungen im
Kern konzentriert waren, und die Hülle von den Elektronen gebildet
wurden (Bild).
Dieses Modell konnte jedoch nicht stimmen: Erstens sollten geladene
Elektronen, die mit einem elektromagnetischen Feld wechselwirken,
nach den Gesetzen der klassischen Physik auf einer Umlaufbahn
Energie verlieren und daher in den Atomkern stürzen. Zum anderen
sollten sie dabei elektromagnetischen Strahlung in allen
Wellenlängen, also ein kontinuierliches Spektrum, abgeben.
Wasserstoff und andere Elemente geben aber Licht nur in bestimmten
Frequenzen ab, ihr Spektrum besteht nur aus Linien (es erinnert ein
wenig an einen Strichcode). Die Erklärung für diese beiden Rätsel,
die zu einem neuen Atommodell führte, griff auf eine neue Idee
zurück – die der Quanten:
Von Licht, Wellen und
Teilchen:
Die Entstehung der Quantenmechanik (Quantenmechanik I)
Zu Beginn des 19. Jahrhunderts war aus dem Versuch heraus, die
Wirkungsweise der Dampfmaschine zu verstehen, die Wärmelehre
zu einem wichtigen Zweig der Physik geworden. Ein Aspekt dabei war
das Strahlungsverhalten sogenannter "Schwarzer Körper", die alle
Strahlung absorbierten und diese, wie 1859 der deutsche Physiker
Gustav Kirchhoff
erkannt hatte, wieder abstrahlten (740).
Kirchhoff hatte vermutet, dass die Strahlungsintensität nur von der
Wellenlänge und der Temperatur abhing; 1893 und 1896 hatte Wilhelm
Wien von der Physikalisch-Technischen Reichsanstalt in Berlin zwei
Gesetze formuliert, eines,
wonach die Wellenlänge der intensivsten Strahlung umgekehrt
proportional der Temperatur sei (je höher die Temperatur, desto
kurzwelliger wird die Strahlung - deshalb wird rotglühende
Grillkohle gelb, wenn man sie anbläst) und eines,
mit dem sich die Verteilung der abgestrahlten Energie über die
ausgesandten Wellenlängen berechnen ließ. Erst ab 1898 ließen sich
diese experimentell überprüfen, und bald zeigte sich, dass das
zweite (das Wiensche Strahlungsgesetz) bei hohen Temperaturen nicht
zutraf - hier passte ein 1900 vom britischen Physiker Lord Rayleigh
formuliertes Gesetz besser. Noch am selben Abend, als er von den
Messergebnissen erfuhr, gelang es dem deutschen Physiker Max
Planck, ein Gesetz zu formulieren, dass die beiden
Gesetze von Wien und Lord Rayleigh zusammenbrachte, das “Plancksche
Strahlungsgesetz”. Dieses gab das gesamte Strahlungsspektrum richtig
wieder.
Allerdings hatte Planck, damit sein Gesetz funktioniert, einen
Faktor h (für "hilf") in seine Formel einbauen müssen. Er hoffte,
diesen bis zur offiziellen Präsentation seiner Formel noch
beseitigen zu können. Das klappte aber nicht, und so bedeutete der
Faktor h, das Licht von einem Schwarzen Körper immer nur in
bestimmten "Päckchen" (Vielfache einer kleinsten möglichen
Energiemenge), die er Quanten nannte, abgegeben
wurde. Eine physikalische Realität schrieb er diesen Quanten aber
nicht zu (744), dies
machte erst 1905 Albert Einstein (746),
als er den photoelektrischen Effekt untersuchte (den Stromfluss, der
entsteht, wenn bestimmte metallische Oberflächen mit Licht bestrahlt
werden - heute Grundlage etwa von Solarstrom und
Digitalfotographie). Der Effekt ist von der Frequenz des Lichtes,
nicht von seiner Intensität (Energie) abhängig, und das ist mit der
klassischen Physik nicht vereinbar. Einstein sah aber, dass es mit
Plancks Quanten zu erklären ist: Wenn ein "Energiepäckchen" mit
ausreichender Energie (und das bedeutet nach Plancks Formel E = h·ν
[ν steht für Frequenz]: mit ausreichend hoher Frequenz) auf ein
Elektron trifft, springt dieses aus seinem Atom und Strom fließt.
Intensives Licht führt aber nicht zu einem Stromfluss, wenn die
einzelnen "Energiepäckchen" zu klein sind. Für Einstein sind die
Quanten also Realität, die Energie des Lichtes müsse man sich als
"lokalisierte Energiequanten" (die heute "Photonen" genannt werden)
vorstellen. (Die Theorie blieb lange umstritten; erst 1923 wurde die
Teilchennatur des Lichts durch die Messung der
Compton-Streuung nachgewiesen.)
Einsteins Vorstellung stieß auch deshalb lange auf Widerspruch, da
schon 1802 der englische Physiker Thomas Young mit dem
Doppelspaltexperiment die Wellennatur des Lichts nachgewiesen
hatte, und auch die Elektrodynamik von James
Clerk Maxwell Licht als elektromagnetische Wellen hoher Frequenz
gedeutet hatte. Der Siegeszug der Quanten begann erst mit Niels
Bohrs Atommodell.
(Weiter zu Quantenmechanik
II)
Die Erklärung der Spektrallinien gelang
Rutherfords Schüler Niels Bohr mit einem
Atommodell, für das er Plancks und Einsteins Quantenidee auf Atome
übertrug: Elektronen konnten nur bestimmte "quantisierte
Energiewerte" annehmen, und sich daher nur auf bestimmten
Umlaufbahnen bewegten. Diese Umlaufbahnen kamen dadurch zustande,
dass die Elektronen sich wie Wellen verhalten konnten, und immer
wenn eine stehende Welle (748)
entstünde, wäre diese eine erlaubte, stabile Umlaufbahn. Beim
Wechsel von einer Umlaufbahn auf eine andere, weniger energiereiche
Umlaufbahn wird Licht, also Energie in Form elektromagnetischer
Wellen, abgestrahlt (da hierbei immer nur zwischen den erlaubten
Umlaufbahnen gewechselt werden kann, wird das Licht in festen
Frequenzen (wegen E = h·ν, siehe oben) abgestrahlt: das erklärt die
Spektrallinien); im umgekehrten Fall wird Licht absorbiert. Der
Wechsel auf eine andere erlaubte Bahn ist der berühmte “Quantensprung”.
Bohr erkannte auch, dass das Verhältnis zwischen Energieänderung und
Frequenz genau dem Planckschen Faktor h entsprach, dieser also die
möglichen Umlaufbahnen bestimmte. Mit der Annahme, dass Teilchen wie
Elektronen sich wie Wellen verhielten, nahm Bohr zudem bereits die
späteren Erkenntnisse von Louis
de Broglie vorweg. Der Quantensprung war zugleich der Beginn
der Erkenntnis des “merkwürdigen” Verhaltens von Materie im
kleinsten Maßstab - die Elektronen gelangen von einer auf die
andere, ohne im Raum dazwischen aufzutauchen.
Quantenmechanik II
Das Dilemma mit der Wellennatur des Lichtes löste 1923 der
französische Physiker Louis de Broglie: Er nahm,
wie Bohr es für die Elektronen gemacht hatte,
an, dass sich auch Licht [und überhaupt alle Teilchen] wie Wellen
verhalten konnte; wie Bohr sah er die Elektronenbahnen als stehende
Wellen. Die Wellenlänge wäre umgekehrt proportional zum Impuls (760)
des Teilchens. Je nach Experiment tritt entweder die eine
(Teilchen-) oder die andere (Wellen-) Eigenschaft hervor; dieses
merkwürdige Verhalten kleinster Teile wird auch als “Welle-Teilchen-Dualismus”
bezeichnet. Im atomaren und subatomaren Bereich kann daher jedes
Teilchen durch eine mathematische Wellenfunktion beschrieben werden
- für diese Entdeckung erhielt de Broglie 1929 den Nobelpreis für
Physik. 1921 wer der deutsche Physiker Max Born Professor in
Göttingen geworden; Niels Bohr leitete seit diesem
Jahr das Institut für theoretischer Physik an der Universität
Kopenhagen.
Dort arbeitete zeitweise auch ein Mitarbeiter Borns, Werner
Heisenberg. Diesem gelang 1925 erstmals die mathematische
Formulierung der Quantenmechanik (770).
Die entscheidende Inspiration hierzu hatte er nachts in einem Park
in Kopenhagen: Er sah einen Mann, der bei seinem Spaziergang immer
wieder unter einer Lampe auftauchte, dazwischen aber unsichtbar war.
Natürlich war er nicht verschwunden, aber was, fragte sich
Heisenberg, wenn das bei subatomaren Teilen, wie den Elektronen auf
der Umlaufbahn, anders wäre? Wenn Elektronen gar nicht um die Bahnen
zögen, sondern nur bei den Übergängen, den "Quantensprüngen", die
man anhand der Lichtabstrahlung messen konnte, auftauchten?
Heisenberg entwickelte die hierzu passenden Gleichungen, die
Bewegungen von Teilchen beschreiben, die nur dann beschrieben
werden, wenn sie mit etwas anderem wechselwirken - Elektronen
materialisieren sich demnach nur dann, wenn sie mit etwas anderem
zusammenstoßen. Die Annahme scheint merkwürdig, aber: Die
Berechnungen auf ihrer Grundlage stimmen mit allen Beobachtungen
überein. Bis heute. 1926 erkannte Max Born, was
die mathematische Formulierung de Broglies bedeutete: Die
Wellenfunktion war das Quadrat der Wahrscheinlichkeit des
Aufenthalts des Teilchens an einem bestimmten Ort im Raum (Born
erhielt dafür 1954 den Nobelpreis für Physik). Borns Erkenntnis
bedeutete eine Wende in der Physik: Der Aufenthaltsort eines
Teilchens lässt sich nicht genau bestimmen, sondern nur eine
Wahrscheinlichkeit angeben, wo es zu finden sein wird (764).
Ebenfalls 1926 entwickelte der österreichische Physiker Erwin
Schrödinger eine Gleichung, mit der sich die zeitliche
Änderung der Welle berechnen lässt; die "Schrödingergleichung" ist
bis heute die Grundlage für viele Anwendungen der Quantenmechanik
(Schrödinger erhielt hierfür gemeinsam mit Paul Dirac 1933 den
Physik-Nobelpreis).
Den nächsten Schritt weg von der klassischen Physik formulierte
1927 Heisenberg mit der Heisenbergschen Unschärferelation
(771). Will man die
Bahn eines Teilchens wie die eines Planeten auf seiner Umlaufbahn
genau bestimmen, muss man den aktuellen Aufenthaltsort und seinen Impuls kennen. Im
Prinzip erfolgt die Messung wie bei einer Radarmessung mit Photonen,
die vom Teilchen reflektiert und gemessen werden. Im subatomaren
Bereich sind die Teilchen aber so klein, dass Photonen beim
Auftreffen auf das Teilchen deren Impuls beeinflussen. Je
energiereicher die Photonen sind, desto genauer messen sie den Ort
des Teilchens, desto größer ist aber ihr Einfluss auf den Impuls.
Umgekehrt kann man den Impuls messen; je genauer aber diese Messung
ist, desto länger dauert sie und desto weniger weiß man über den
aktuellen Aufenthaltsort. Man kann also nie beide Größen zusammen
genau messen, je genauer man die erste Größe misst, desto ungenauer
muss die Messung der zweiten sein. Die Heisenbergsche
Unschärferelation ist die mathematische Formulierung dieses
Phänomens und zeigt, dass das Produkt der beiden Unschärfen größer
sein muss als das Planksche Wirkungsquantum. Die Unschärferelation
gilt auch für andere Paare von Eigenschaften eines Teilchens, etwa
Energie und Veränderungsrate.
(Weiter zu Quantenmechanik III)
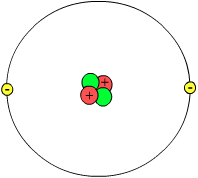 Der
prinzipielle Aufbau eines Atoms: Der Kern besteht aus positiv
geladenen Protonen (hier rot) und ungeladenen Neutronen (hier grün),
die Hülle aus negativ geladenen Elektronen (hier gelb). Die
Abbildung ist aus zwei Gründen aber mit Vorsicht zu genießen: Sie
ist nicht maßstäblich; der Kern umfasst in Wirklichkeit weniger als
1/100.000 des Volumens des Atoms - eine Fliege in einem Stadion! Das
Atom ist also im Wesentlichen leer. Zweitens: Die Elektronen sind
“unsichtbar”: Heisenbergs Unschärferelation besagt, dass die
Einwirkung von Licht sie verändern würde. Daher stellt man sich
Elektronen besser als “Elektronenwolke” vor (>> mehr).
Abb. >> wikipedia,
Lizenz >>
GNU FDL.
Der
prinzipielle Aufbau eines Atoms: Der Kern besteht aus positiv
geladenen Protonen (hier rot) und ungeladenen Neutronen (hier grün),
die Hülle aus negativ geladenen Elektronen (hier gelb). Die
Abbildung ist aus zwei Gründen aber mit Vorsicht zu genießen: Sie
ist nicht maßstäblich; der Kern umfasst in Wirklichkeit weniger als
1/100.000 des Volumens des Atoms - eine Fliege in einem Stadion! Das
Atom ist also im Wesentlichen leer. Zweitens: Die Elektronen sind
“unsichtbar”: Heisenbergs Unschärferelation besagt, dass die
Einwirkung von Licht sie verändern würde. Daher stellt man sich
Elektronen besser als “Elektronenwolke” vor (>> mehr).
Abb. >> wikipedia,
Lizenz >>
GNU FDL.
Der Atomkern
Rutherford hatte sich auch mit dem Atomkern beschäftigt, und
angenommen, dass es im Atomkern neben den positiv geladenen Teilchen
- die aufgrund der Abstoßung auseinanderfliegen müssten - als eine
Art Klebstoff neutrale Teilchen geben müsse, die er Neutronen
nannte. Sie wurden 1932 von Rutherfords Mitarbeiter James
Chadwick (750)
nachgewiesen. Damit war das Bild des Atoms bekannt, das im Prinzip
auch heute noch gilt (Abbildung rechts). Protonen und Neutronen
machen über 99,9 Prozent der Masse eines Atoms aus, aber nur einen
winzigen Anteil seines Volumens.
Die chemischen Elemente (Stoffe, die sich durch chemische oder
mechanische Methoden nicht weiter zerlegen lassen) unterscheiden
sich durch die Zahl der Protonen im Kern. Die Protonenzahl ist daher
charakteristisch für jedes Element; deshalb wird sie auch als
“Ordnungszahl” für die chemischen Elemente verwendet. Das einfachste
Atom ist das Wasserstoffatom mit 1 Proton im Kern, das rechts
abgebildete Atom mit 2 Protonen ist ein Heliumatom. Ihre
Ordnungszahlen sind 1 (Wasserstoff) und 2 (Helium). Die Chemiker
kennen bisher 118 chemische Elemente, von denen einige nur künstlich
hergestellt wurden - natürlich kommen 92 chemische Elemente im
Universum und auf der Erde vor, von denen 80 stabil und 30 auf der
Erde weit verbreitet sind. Das Universum insgesamt besteht zu 73
Prozent aus Wasserstoff und zu 25 Prozent aus Helium, die restlichen
90 Elemente machen zusammen gerade zwei Prozent aus. Die Aufzählung
der chemischen Elemente nach Ordnungszahl und sortiert nach
chemischen Eigenschaften kennen Chemiker als “Periodensystem".
Bei vielen Elementen entspricht die Zahl der
Neutronen im Atomkern der Zahl der Protonen; bei manchen Elementen
gibt es aber auch Atome mit einer höheren Zahl an Neutronen - solche
Atome werden Isotope eines Elements genannt. So
gibt es zum Beispiel Kohlenstoff (C, 12 Protonen) auch mit 13 oder
14 Neutronen - also als Kohlenstoff-Isotope “C-13” und “C-14”. Da
Neutronen relativ massereich sind, legen die Atome dadurch an
Gewicht zu, und man spricht auch von “schweren” Elementen, “C-13”
und “C-14” wären also “schwerer Kohlenstoff”.
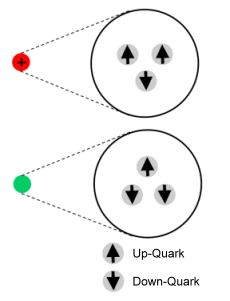 Protonen (oben) und Neutronen (unten)
sind aus Quarks zusammengesetzt. (Die Abbildung ist nicht
maßstäblich: Die Quarks umfassen nur ein Millionstel des Volumens
der Kernbausteine.) Eigene Abbildung.
Protonen (oben) und Neutronen (unten)
sind aus Quarks zusammengesetzt. (Die Abbildung ist nicht
maßstäblich: Die Quarks umfassen nur ein Millionstel des Volumens
der Kernbausteine.) Eigene Abbildung.
Ähnlich wie das Atom erwiesen sich auch die
Bausteine des Atomkerns, die Protonen und die Neutronen, als
teilbar: Mit “Teilchenbeschleunigern”
auf andere Teilchen geschossen, zerplatzen sie oder wandeln sich in
Energie um, die wiederum zu neuen Materieteilchen verdichtet. Anfang
der 1960er Jahre zeigte sich, dass Protonen und Neutronen aus drei
Bausteinen bestehen, den Quarks. Den Namen prägte
der US-amerikanische Physiker Murray Gell-Mann.
Quarks sind ungeheuer klein: Sie machen nur rund ein Millionstel des
Volumens eines Protons aus - Atome sind im wesentlichen wirklich
leer! Quarks werden nach ihrer elektrischen Ladung als Up- oder als
Down-Quark bezeichnet; ein Up-Quark hat die Ladung 2/3, ein
Down-Quark die Ladung -1/3. Ein Proton besteht aus zwei Up-Quarks
und einem Down-Quark, ein Neutron aus zwei Down-Quarks und einem
Up-Quark. Die Ladung der Protonen ergibt sich aus der Ladung der
Quarks (2/3 + 2/3 - 1/3 = 3/3 = 1); die Neutralität der Neutronen
ebenso. Allerdings würden die Protonen aufgrund der elektrischen
Abstoßung auseinanderfliegen; da dies nicht geschieht, müssen sie
noch andere “Ladungen” tragen, die diese Abstoßung ausgleichen -
diese werden mit Farbnamen bezeichnet; es gibt “rote”, “grüne” und
“blaue” Quarks (wobei die Farbnamen nur der Unterscheidung dienen
und nichts mit Farben zu tun haben). Wenn diese drei Werte
zusammenkommen, heben sich die Ladungen gegenseitig auf und die
Quarks bilden ein stabiles System, eben ein Proton oder Neutron. Die
dabei vermittelte, die Quarks zusammenhaltende Kraft ist die “Starke
Kraft” (auch “Starke Wechselwirkung” genannt), eine der vier
Grundkräfte der Physik. Ein Quark wird also durch zwei Faktoren
beschrieben: durch die Eigenschaft Up oder Down und seine
Farbladung; insgesamt kennen wir damit sechs Quarks (Up-”rot”,
“grün”, “blau” und Down-”rot”, “grün”, “blau”).
Die subatomare Zeit
Wenn beim Beschuss in Teilchenbeschleunigern Quarks
entstehen, dauert es bei manchen nur Billionstelsekunden, bis sie
wieder zerfallen. Das scheint extrem kurz - aber auch hier trügt,
wie so oft auf subatomarer Ebene, der Schein. Physikern gelten die
Quarks als sehr stabil, drehen sie doch in dieser Zeit eine
Billionen Runden, wesentlich mehr als etwa die Erde in den über 4,5
Milliarden Jahren ihrer Existenz an Sonnenumläufen geschafft hat und
noch schaffen wird. Merke: Auch Zeitangaben ändern mit abnehmenden
Dimensionen ihre Bedeutung, menschliche Maßstäbe verlieren dort
ihren Sinn.
Quantenmechanik III
Heisenbergs Gleichung von 1925 war kurz nach ihrer Veröffentlichung
von dem englischen Physiker Paul Dirac zur
umfassenderen Dirac-Gleichung weiterentwickelt worden (774).
Dirac zeigt, dass nicht nur die Bahn, sondern sämtliche Variablen
eine Objektes (Drehimpuls, elektrisches Potenzial, etc.) zwischen
einer Wechselwirkung und der nächsten unbestimmt sind. Bei einer
Wechselwirkung können die Variablen (analog dem Ort der Elektronen
beim Quantensprung) immer nur bestimmte Werte annehmen. Diracs
Gleichung lieferte das Rezept, diese zu berechnen. Sie kann aber,
wie von Born vorhersagt, keine genauen Werte, sondern nur
Wahrscheinlichkeiten liefern. Ebenso kann man mit der Gleichung eine
Wahrscheinlichkeit berechnen, welche Werte sie bei der nächsten
Wechselwirkung annehmen (Übergangswahrscheinlichkeit). Bei einer
Messung "bricht die Wellenfunktion zusammen", und es werden (im
Rahmen der Unschärferelation) konkrete Werte gemessen. Eine
praktische Anwendung dieser Erkenntnisse sind die Orbitale der
Atomhülle. Dirac entdeckte aber noch etwas: seine Gleichungen ließen
sich auch auf die Felder anwenden, die
Faraday und Maxwell entdeckt hatten.
(Weiter zu Quantenmechanik
IV.)
Die Atomhülle
Die Elektronen der Atomhülle sind bis heute unteilbar, insofern
besteht also die “gewöhnliche” Materie der Erde letztlich aus
Up-Quarks, Down-Quarks und Elektronen (zu weiteren Elementarteilchen
siehe Box
Die Elementarteilchen). Aber auch das Elektron und vor allem
seine Bahn erwiesen sich als komplex: Mit der Erkenntnis, dass
Elektronen auch als Welle beschrieben werden können und ihre
Aufenthaltswahrscheinlichkeit an einer bestimmten Stelle nur in Form
einer
Wellenfunktion beschrieben werden kann und die genaue
Bestimmung von Ort und Impuls eines Teilchens aus prinzipiellen
Gründen unmöglich ist (Heisenbergs Unschärferelation), ergab sich,
dass statt einer Bahn nur Aufenthaltsräume, sogenannte Orbitale,
angegeben werden - man berechnet einen Raum, in dem sich das
Elektron mit 90-prozentiger Wahrscheinlichkeit aufhält. Die
einfachste mögliche Form eines Orbitals ist die Kugelform
(“s-Orbital”); sie kommt etwa beim Wasserstoff vor.
Die Elektronen können sich, wie Niels Bohr
herausgefunden hat, nur auf bestimmten Bahnen bewegen, die
diese Bahnen aber nicht angegeben werden können, spricht man heute
lieber von “erlaubten Zuständen”; diese bilden ineinandergefügte “Schalen”.
Jede Schale kann nur eine bestimmte Anzahl von Elektronen aufnehmen;
diese Anzahl steigt von innen nach außen. Die Anzahl der Elektronen
eines Atoms entspricht meist der Anzahl der Protonen, dann sind
Atome neutral - ein Zustand, den sie “anstreben”. Dieses
“Streben” ist auch die Grundlage für die Erzeugung eines elektrischen
Stroms - dieser ist nichts anders als ein Strom geladener
Teilchen; ein Strom von Elektronen, die von “ihren” Protonen
getrennt wurden und nun dahin fließen, wo Elektronen “fehlen” (und
daher eine positive Ladung herrscht). (Um Elektronen und Protonen zu
trennen, muss Arbeit geleistet werden: Dazu dienen die verschiedenen
Methoden der Stromerzeugung, wobei zumeist die “andere Hälfte” des
Elektromagnetismus, der Magnetismus,
genutzt wird. Zur Geschichte der Elektrizitätserzeugung und
-nutzung mehr
hier). Die Elektronenbesetzung der äußersten Schale
schließlich prägt das chemische Verhalten eines
Elements (mehr dazu unten
auf dieser Seite).
2 Was die Welt zusammenhält: Kräfte
Teilchen beschreiben die Welt nicht allein: es braucht auch etwas,
was die Teilchen zusammenhält - und es gibt genau vier Arten, wie
Teilchen miteinander in Beziehung treten. Zwei davon, die
Schwerkraft und die elektromagnetische Kraft, sind seit langem
bekannt; die beiden anderen, die starke und die schwache Kraft,
wirken im Atomkern und wurden erst von der modernen Atomphysik
entdeckt. Zusammen werden sie als die vier Grundkräfte
bezeichnet. Mit der Schwerkraft hatte schon Newton
den Lauf der Planeten erklärt; Albert Einstein mit seiner
Allgemeinen Relativitätstheorie ihre Ursache gefunden. Dass
Elektrizität und Magnetismus miteinander verwandt sind, hatte der
englische Naturforscher Michael Faraday im 19.
Jahrhundert entdeckt und erklärt: Faraday griff die Erkenntnisse des
dänischen Naturforscher Hans Christan Ørsted auf, dass eine
Kompassnadel ausschlug, wenn ein elektrischer Strom eingeschaltet
wurde, und entdeckte die elektromagnetische Induktion (dem
Grundprinzip, mit dem heute Stromgeneratoren
arbeiten). Bei seinen weiteren Untersuchungen stellte er sich auch
die Frage, wie denn die Kraftübertragung erfolgte, hatten doch
Magnet und Stromleiter keinen Kontakt. er stellte sich "Kraftlinien"
zwischen elektrischen und magnetischen Körpern vor, die von diesen
Körpern ausgehen und andere Körper wie ziehende oder schiebende
Drahtseile abstoßen oder anziehen. Faraday dachte lange darüber
nach, ob diese Kraftlinien nur eine Vorstellung oder aber eine
physikalische Realität sind, entschied sich dann für letzteres.
Faraday, der großen Wert darauf legte, seine naturwissenschaftlichen
Ergebnisse auch für Laien verständlich zu machen, machte die
Kraftlinien (= Feldlinien, 1848 sprach Faraday erstmals für die
Summe der Kraftlinien von einem Feld [520])
mit Eisenfeilspäne sichtbar.
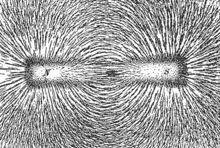 Eisenfeilspäne
auf Papier zeichnen die Richtung der Kraftlinien (heute: Feldlinien)
eines Magneten nach. Abb. aus Newton Henry Black, Harvey N. Davis
(1913) Practical Physics, The MacMillan Co., USA, p. 242, fig. 200.
Public domain.
Eisenfeilspäne
auf Papier zeichnen die Richtung der Kraftlinien (heute: Feldlinien)
eines Magneten nach. Abb. aus Newton Henry Black, Harvey N. Davis
(1913) Practical Physics, The MacMillan Co., USA, p. 242, fig. 200.
Public domain.
Faradays Ideen faszinierten den jungen
schottischen Physiker und Mathematiker James Clerk Maxwell.
Dieser wollte Faradays Ideen von Feldern und Kraftlinien
mathematisch formulieren. Seine erste Arbeit, "Über Faradays
Kraftlinien", erschien 1856. In dieser zeigte er, wie elektrische
und magnetische Felder zusammenhängen (Faradays Urheberschaft für
diese Idee erkannte er an: „Faraday ist der Vater der erweiterten
Lehre des Elektromagnetismus, und wird dies immer bleiben“). 1864
veröffentlichte er erstmals seine Gleichungen, die aus Maxwell den
Wissenschaftler machten, der nach weitverbreiteter Meinung den
größten Einfluss auf das 20. Jahrhundert hatte (780):
die Maxwell-Gleichungen. Anfangs waren es 20, später wurden sie
durch die Vektorschreibweise zu vier Gleichungen
zusammengefasst. Maxwells Gleichungen sagten voraus, dass
elektromagnetische Felder schwingen und sich im leeren Raum als
Wellen mit Lichtgeschwindigkeit ausbreiten. Maxwell vermutete daher,
dass auch das Licht, Wärme- und andere Strahlung, darunter eine noch
unbekannte Strahlung niedriger Frequenz, die von der Bewegung
elektrischer Ladungen ausgehen und ihrerseits solche Bewegungen
auslösen sollte, elektromagnetische Wellen seien. 1886 gelang es dem
deutschen Physiker Heinrich Hertz, die Existenz
solcher elektromagnetischer Wellen und ihre Identität Licht
nachzuweisen, womit sich Maxwells Sicht der Dinge endgültig
durchsetzte. (Einige Jahre später nutzte der Italiener Guglielmo
Marconi die von Maxwell vorhergesagte Wellen niedriger Frequenz zum
Bau des ersten Radiogerätes.) Mit seinen Arbeiten hatte Maxwell
mechanische, elektrische und optische Erscheinungen in einer Theorie
vereint; und seine Kraftwellen erwiesen sich, wenn sie in einer
bestimmten Frequenz schwingen, sogar als sichtbar: Sie waren nichts
anderes als Licht. Röntgenstrahlung, Licht, Mikrowellen und
Radiowellen - alles sind elektromagnetische Wellen, die sich nur in
der Wellenlänge unterscheiden:
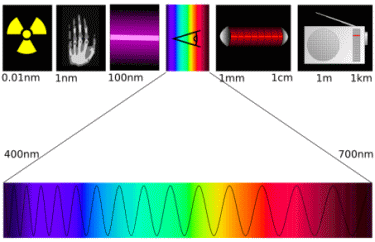
Elektromagnetische Wellen: Das
Spektrum reicht von der radioaktiven Gammastrahlung über
Röntgenstrahlung,
UV-Strahlung, sichtbarem Licht (unten vergrößert), Infrarotstrahlung
(=Wärmestrahlung) über Mikrowellenstrahlung
(nicht abgebildet) bis zu Radiowellen. Abbildung: User:Tatoote und
User:Phrood, wikipedia commons, Lizenz:
>> cc
3.0.
Mit dem Elektromagnetismus war die Kraft gefunden, die neben der
Schwerkraft die meisten Bewegungen in der Natur erklärte (etwa auch
die chemischen Bindungen). Fehlen noch zwei Kräfte: Die schwache
Kernkraft wurde 1933 von Enrico Fermi bei der
Untersuchung des radioaktiven Zerfalls von
Atomen entdeckt; sie löst bestimmte radioaktive
Zerfallsprozesse (den ß-Zerfall) aus (786),
die in den 197oer Jahren beschriebene starke Kernkraft
hält die Quarks im Atomkern zusammen. Für Physiker sind die vier
Grundkräfte Ausdrücke einer einzigen “Urkraft”, aus der sie während
des Urknalls
hervorgegangen sind; und da selbst Materie nur eine andere Seite von
Energie ist, wie Albert Einstein mit seiner Speziellen
Relativitätstheorie gezeigt hat, ist das Verstehen dieser
ursprünglichen Gemeinsamkeit und die Vereinigung der vier
Grundkräfte in einer einzigen Gleichung die
Herausforderung der modernen Physik (das Ergebnis könnte die
"Weltformel" sein).
Quantenmechanik IV
Der erste Anlauf war die oben beschriebene
Anwendung der Quantenmechanik und der Speziellen Relativitätstheorie
auf Faradays elektromagnetische Felder durch Paul Dirac. Die
Anwendung seiner Gleichungen zeigte, dass die Energie der Felder
immer nur bestimmte Werte annehmen kann: sie verhält sich wie
Plancks und Einsteins Energiequanten! Elektromagnetische Wellen
zeigen sich, sobald sie mit etwas anderem wechselwirken, als
Teilchen. Andersherum: alle Teilchen sind Quanten eines Feldes, so
Diracs zentrale Entdeckung. Die Dirac-Gleichung
von 1928 ist für diese Quantenfelder die Feldgleichung; die
Erkenntnis begründete die allgemeine Quantenfeldtheorie,
die Grundlage der heutigen Teilchenphysik. Alle Materie besteht
demnach aus Quantenfeldern, die sich in Form von Teilchen (wie den
Photonen oder den Elektronen) oder als Wellen wie den
elektromagnetischen Wellen zeigen. (Der experimentelle Nachweis der
von de Broglie vorausgesagten Materiewellen war 1927 den
amerikanischen Physikern Clinton Davisson und Lester Germer gelungen
[Davisson erhielt hierfür 1937 den Physik-Nobelpreis]). Teilchen
sind demnach nichts anderes als Erregungszustände (Dellen oder
Kräuselungen) des Quantenfeldes. Diracs Gleichung sagte zudem die
Existenz einer neuen Größe, des Spin (789),
sowie von Antiteilchen (deren elektrische Ladung
der der Teilchen entgegengesetzt ist, 790)
voraus.
Die quantenfeldtheoretische Beschreibung des Elektromagnetismus
gelang in den 1940er Jahren den amerikanischen Physikern Richard
Feynman und Julian Schwinger sowie
unabhängig von ihnen ihrem japanischen Kollegen
Shin’ichirō Tomonaga mit der Entwicklung der
Quantenelektrodynamik (QED), für die die drei 1965 den
Physik-Nobelpreis erhielten. Diese Theorie besagt, dass die
gegenseitige Abstoßung von Elektronen (wie jede elektromagnetische
Wechselwirkung, sei es Anziehung, sei es Abstoßung) durch den
Austausch von Teilchen, den Photonen, vermittelt
werden muss. Da sich elektrisch geladene Teilchen sowohl anziehen
als auch abstoßen können, scheinen die Photonen keine Kräfte zu
übertragen, sondern eher Botschaften (“bewegt euch auseinander” oder
“bewegt euch aufeinander zu”), sie werden daher oft als Boten- oder
Austauschteilchen bezeichnet. Diese Austauschteilchen tauchen aus
dem Nichts auf und verschwinden danach wieder, sie werden daher auch
als “virtuelle Teilchen” bezeichnet. (Dieses Auftauchen von Teilchen
aus dem Nichts ist durch die Quantenfluktuation
möglich.)
1961 zeigte der deutsche Physiker Claus Jönsson, dass auch
Elektronen bei einem Doppelspaltexperiment wie Licht
ein Interferenzmuster erzeugen. Unerwartet war dabei: Das
Interferenzmuster entstand auch, wenn einzelne Elektronen
nacheinander gesendet wurden - kann also nicht durch die
Überlagerung mit Wellenmustern eines anderen Teilchen entstanden
sein. Vielmehr scheint es so, als beeinflusst sich das Teilchen
irgendwie selbst. Als Erklärung hierfür schlug Richard Feynman vor,
dass jedes einzelne Elektron alle möglichen Bahnen vom Start- zum
Zielpunkt zurücklegen kann, also auch durch jede der beide Spalten.
Jedes einzelne Elektron nimmt einen der möglichen Wege und fliegt
durch eine der Spalten; in der Summe werden die Wege aber durch die
Wellenfunktion beschrieben (das Wellenmuster tritt auch nur auf,
wenn man viele einzelne Elektronen misst). Auch hier gibt die
Wellenfunktion also die Wahrscheinlichkeit an, mit der das Elektron
an einer bestimmten Stelle auf den Schirm trifft. Die Summe aller
möglichen Wege lässt sich mit der von Feynman weiterentwickelten
“Pfadintegralmethode” berechnen, die ergibt das gleiche Ergebnis wie
die Wellenfunktion. Elektronen, die auf nicht genau festgelegten
Bahnen fliegen können - solche Ergebnisse zeigen, dass Vorgänge auf
subatomarer Ebene ganz anders ablaufen können, als unser Verstand,
der vom Umgang mit mittleren Größenordnungen geformt
wurde, intuitiv erfassen kann (nicht anders als auch bei den
großen Dimensionen der
Relativitätstheorie). (Ob Feynmans Annahme tatsächlich stimmt,
kann man aber nicht prüfen, denn sobald die Physiker versuchen, der
Bahn des Elektrons zu folgen, verschwindet das Interferenzmuster!
Den Grund haben wir schon gesehen: die Beobachtung beeinflusst das
Verhalten der Teilchen.)
Diese Unmöglichkeit genauer Messungen ist, so haben die
Untersuchungen des nordirischen Physikers John Bell
und des französischen Physikers Alain Aspect und
seiner Mitarbeiter gezeigt, nicht nur ein Problem der Messungen,
sondern spiegelt eine quantenmechanische Tatsache wider: Die
Unbestimmtheit von Energie und Impuls sind eine grundsätzliche
Eigenschaft im subatomaren Bereich, ihre Schwankungen werden auch
als Quantenfluktuation bezeichnet. Schwankungen der Energie
ermöglichen es dann - da Energie nach E=mc² in Masse umgewandelt
werden kann - dass Teilchen aus dem Nichts
auftauchen und wieder verschwinden können.)
Ähnliche Quantenfeldtheorien
entstanden für die starke Kraft (Quantenchromodynamik, verbunden mit
Namen wie Murray Gell-Mann, Harald Fritzsch und Heinrich Leutwyler)
und die schwache Kraft, die mit der elektromagnetischen Kraft in der
Quantenfeldtheorie der elektroschwachen Kraft
vereinigt wurde (Glashow, Salam und Weinberg, die dafür 1979 den
Nobelpreis für Physik erhielten). Analog zu den Photonen der
elektromagnetischen Kraft werden auch den anderen
Quantenfeldtheorien zufolge Kräfte durch Austauschteilchen
übertragen; dies sind die Gluonen für die starke
Kraft und die “schwachen Eichbosonen”, das “W+”,
das “W-” und ein neutrales “Z”-Teilchen,
für die schwache Kraft (792).
Quantenfelder ähneln den klassischen elektromagnetischen Feldern,
können aber - wie oben bei den virtuellen Photonen gesehen -
jederzeit virtuelle Teilchen produzieren oder verschwinden lassen.
Teilchen werden in diesen Theorien als eine Art Erregungszustand des
Feldes verstanden: entstehen in einem konstanten Feld Dellen oder
Kräuselungen, entsteht ein Teilchen; wird die Delle oder Kräuselung
absorbiert, verschwindet das Teilchen wieder.
Das Standardmodell
der Teilchenphysik
Das Standardmodell der Teilchenphysik beschreibt die bekannten
Elementarteilchen und die drei wichtigsten Wechselwirkungen zwischen
ihnen. Wie wir gesehen haben, besteht die gewöhnliche Materie aus
drei Elementarteilchen und drei Wechselwirkungen: Die Elektronen
sind mittels elektromagnetischer Wechselwirkung an
den Atomkern gebunden, der aus Protonen und Neutronen besteht, die
wiederum aus (Up- und Down-)Quarks zusammengesetzt
sind, die von der starken Wechselwirkung (starke
Kernkraft) zusammengehalten werden. Daneben gibt es die schwache
Wechselwirkung (schwache Kernkraft), die keine Bindungen
auslöst, aber mit Neutrinos (794)
wechselwirkt, etwa bei den Kernreaktionen in der Sonne. Die
Wechselwirkungen werden durch Austauschteilchen vermittelt, den Photonen
(elektromagnetische Wechselwirkung),“W+”,
“W-” und “Z”-Teilchen (schwache
Kernkraft) sowie Gluonen (starke Kernkraft.
Hieraus ist alles, wir sehen können, aufgebaut.
Das Kleingedruckte: Auch wenn die oben genannten drei Teilchen und
drei Wechselwirkungen die für unser tägliches Leben relevanten sind,
soll der Vollständigkeit halber darauf hingewiesen werden, dass zum
Standardmodell weitere Teilchen gehören. Da ist zum einen das erst
2012 entdeckten Higgs-Teilchen,
mit dem der Higgs-Mechanismus, der für die Massen der
Elementarteilchen verantwortlich ist, nachgewiesen wurde; zum
anderen kommen im Standardmodell zu den genannten Elementarteilchen,
die die Materie auf der Erde bilden (den Fermionen, siehe unten), je
zwei - “zweite” und “dritte Generation” genannte - schwerere
“Verwandte” hinzu, die gegenwärtig nur in Hochenergie-Teilchenbeschleunigern
erzeugt werden. Soweit bekannt ist, spielen diese auf der Erde kaum
eine Rolle (das Myon [siehe unten] beeinflusst möglicherweise die
Mutationsrate von DNS). Dazu kommen die von Dirac vorhergesagten
Antiteilchen, die ebenfalls in Teilchenbeschleunigern erzeugt werden
können. Sowohl die schweren Teilchen als auch die Antiteilchen
zerfallen sehr schnell wieder; sie sind trotzdem von großem
wissenschaftlichen Interesse, da sie kurz nach dem Urknall auch
natürlich vorgekommen sind und sehr wahrscheinlich eine wichtige
Rolle spielen werden, wenn es darum geht, den grundlegenden
physikalischen Aufbau des Universums zu verstehen. Auch die für uns
nicht spürbaren Neutrinos können wertvolle Informationen nicht nur
über die Entstehung des Universums liefern, sondern, die sie auch
bei den Fusionsreaktionen im Inneren der Sonne entstehen, z.B. auch
Aufschluss über die Schwankungen dieser Reaktionen geben.
Um die Vielfalt der Teilchen besser zu verstehen, werden sie im
Standardmodell in Bosonen und Fermionen eingeteilt, je nach ihrem
Spin (789): Bei den Bosonen
ist der Spin immer ganzzahlig (also 0 [kein Spin], 1, 2), bei den Fermionen
halbzahlig (1/2, 3/2). Ob eine Teilchen ein Boson oder ein Fermion
ist, bestimmt sein Verhalten bei Wechselwirkungen: Fermionen vom
selben Typ können niemals am selben Ort zu finden sein. Elektronen
sind Fermionen, Elektronen mit demselben Spin müssen
deshalb verschiedene Umlaufbahnen haben. Bosonen verhalten sich
genau umgekehrt, sie kommen am liebsten zusammen vor, deshalb kann
Licht (Photonen sind Bosonen) sich z.B. überlagern. Ob Teilchen mit
Spin sich so verhalten, als wenn sie sich im Uhrzeigersinn oder
entgegen dem Uhrzeigersinn bewegen, macht auch einen Unterschied:
linkshändige (im Uhrzeigersinn drehende) Teilchen unterliegen der
schwachen Wechselwirkung, rechtshändige nicht. Die Fermionen können
zudem weiter in Quarks (die der starken
Wechselwirkung unterliege) und Leptonen (bei denen
das nicht der Fall ist) untergliedert werden. Die folgende Tabelle
zeigt einen Überblick über die Elementarteilchen der
Standardtheorie:
Fermionen:
| |
Up-Quark |
Down-Quark |
Neutrino |
Elektron |
zweite
Generation |
Charm |
Strange |
Myon-
Neutrino |
Myon |
| dritte Generation |
Top |
Botton |
Tau-Neutrino |
Tau |
| |
Quarks |
Quarks |
Leptonen |
Leptonen |
Bosonen:
| Elektromagnetische
Wechselwirkung |
schwache
Wechselwirkung |
starke
Wechselwirkung |
keine Wechselwirkung |
| Photon |
W+,
W-, Z |
Gluon |
Higgs-Teilchen |
Es könnte durchaus sein, dass in Zukunft noch weitere
Elementarteilchen gefunden werden, etwa eines oder mehrere, die die
dunkle Materie
ausmachen. Praktische Auswirkungen auf unser Leben auf der Erde wird
das, wie schon die Entdeckung des Higgs-Teilchens, aber nicht haben:
würden sie mit anderer Materie in bedeutsamer Weise wechselwirken,
hätten wir sie längst gefunden. Zusammen mit der
Relativitätstheorie, die die
gravitative Wechselwirkung (Schwerkraft) erklärt, bildet das
Standardmodell den Kern der heutigen Physik. Dieser Kern reicht
absolut aus, um aus physikalischer Sicht alle praktischen Fragen
unseres Lebens auf der Erde zu behandeln. Erst, wenn wir in der
Nähe von Schwarzen
Löchern oder des Urknalls
kommen, gibt es ein Problem: Quantenmechanik und
Relativitätstheorie widersprechen sich in solchen
Extremsituationen (und nur dort). Deshalb interessiert dieser
Widerspruch vor allem bei der Erforschung des Weltraums.
3 Vom Atom zum Stoff – das Reich der Chemie
Während die Physiker sich bemühen, die “Urkraft”, aus der Energie
und die Elementarteilchen hervorgegangen sind, in einer einzigen
Gleichung zu beschreiben, beschäftigen die Chemiker sich damit, was
diese etwa 100 verschiedenen Atome hervorbringen: Wenn Atome sich
verbinden, entstehen Stoffe mit völlig neuen Eigenschaften; so erst
entstand die schier endlose Vielfalt von festen, flüssigen oder
gasförmigen Strukturen, die die Welt ausmachen. Diese Verwandlung
der Stoffe zu verstehen, ist das Arbeitsgebiet der Chemie. Auch wenn
Atome sich als teilbar erwiesen, blieben sie die Grundlage der
Chemie - an chemischen Reaktionen ist nämlich nur
die äußere Schale der Atomhülle beteiligt. Als “selbstständige”
Atome kommen natürlicherweise nur die wenigsten Elemente vor,
nämlich die Edelgase - und dies liefert den Schlüssel zum
Verständnis chemischer Reaktionen: Die Anzahl der Elektronen in der
Atomhülle der Edelgase (Helium: 2, Neon: 10, Argon: 18 usw.) ist ein
günstiger, "stabiler" Zustand, den Atome "anstreben" - Elemente,
denen Elektronen fehlen, nehmen welche auf (und werden
"Elektronenakzeptoren" genannt), Elemente, die zu viele Elektronen
haben, geben diese ab (und werden "Elektronendonatoren" genannt).
Man kann drei Arten von chemischen Verbindungen unterscheiden:
- Atombindungen: Die beteiligten Atome bilden
eine gemeinsame Elektronenhülle; es entstehen Moleküle.
- Ionenbindungen: Ein beteiligtes Atom gibt ein
oder mehrere Elektronen an einen anderen Partner ab.
- Metallbindungen: Positiv geladene Metallionen
bilden ein Gitter, in dem sich frei bewegliche Elektronen
verteilen.
Das einfachste Molekül ist das
Wasserstoffmolekül: Es besteht aus zwei Wasserstoffatomen (mit je
einem Elektron in der Hülle - in der Summe also zwei Elektronen) und
wird daher H2 geschrieben (H für lateinisch hydrogenium
- Wassererzeuger - ist das chemische Symbol für Wasserstoff).
Moleküle bestehen oft aus verschiedenen Atomen, so wird ein
Wassermolekül etwa aus zwei Wasserstoff- (H) und einem
Sauerstoffatom (O) gebildet, seine chemische Formel heißt
entsprechend (H2O) (in seiner Elektronenhülle gibt es 10
Elektronen - acht vom Sauerstoff, und zwei vom Wasserstoff).
Die Ionenbindungen beruht auf der
elektrostatischen Anziehung geladener Atome (diese heißen “Ionen”),
die durch die Abgabe bzw. Aufnahme von Elektronen zwischen den
beteiligten Atomen entstehen. Durch ihre Ladungen ordnen sich die
Verbindungen in hochgeordneten Mustern an - sie bilden Kristalle.
Die Salze sowie die meisten Minerale (die Baustoffe der Gesteine)
und Edelsteine basieren auf Ionenbindungen.
Bei der Metallbindung
(bei Metallen und Legierungen vorkommend) schließlich können sich
die Elektronen, wenn sich kein geeigneter Elektronenakzeptor findet,
selbstständig machen: Die entstehenden positiv geladene Metallionen
bilden ein Gitter, in dem die Elektronen sich als "Elektronengas"
verteilen; die Bindung entsteht durch die Anziehung der positiven
Ionen und der negativen Elektronen. Die frei beweglichen Elektronen
sorgen dafür, dass Metalle gute Strom- und Wärmeleiter und außerdem
biegsam sind - was sie zu wichtigen Werkstoffen macht.
Im engen Sinne nicht zu den chemischen Verbindungen, aber in der
Natur sehr bedeutend sind vergleichsweise schwache Wechselwirkungen,
die ebenfalls Moleküle verbinden können. So sind Wassermoleküle über
Wasserstoffbrückenbindungen untereinander verbunden
(>> mehr).
Solche Wasserstoffbrücken spielen auch eine wichtige Rolle bei
vielen anderen Molekülen, so verbinden Sie etwa die beiden Stränge
der >> DNS;
und sie tragen zur dreidimensionalen Form von Proteinen bei. Ebenso
können die van-der-Waals-Kräfte, nach einem
holländischen Physiker benannt, Stoffe verbinden: Sie beruhen im
wesentlichen auf der elektrischen Anziehung, die durch feine
Verschiebungen der Ladungen durch die gegenseitige Abstoßung der
Elektronen in der Hülle zustande kommen, und sind nur etwa ein
Viertel so stark wie die Wasserstoffbrückenbindung. Auch sie spielen
in einigen Mineralen eine Rolle.
Diese Stoffe und Bindungen also bilden die Welt, die wir kennen: Luft
etwa ist ein Gemisch vor allem aus Stickstoff- (N2) und
Sauerstoffmolekülen (O2) mit Argon und zahlreichen
Spurengasen (mehr >> hier).
Stickstoff und das Edelgas Argon sind extrem reaktionsträge, und
darum reagieren sie nicht mit dem sehr reaktionsfreudigen Sauerstoff
- zu unserem Glück. Die Wolken am Himmel und der Regen
bestehen aus Wasser (mehr >> hier);
Gesteine bestehen aus Mineralen, etwa den Silikaten
(gebildet aus Silizium, Sauerstoff und einem oder mehreren Metallen)
oder Karbonaten, Salzen der Kohlensäure, z.B. Kalziumkarbonat
(Calcit) oder Kalziummagnesiumkarbonat (Dolomit). Aber auch Lebewesen
sind aus Sicht eines Chemikers nur chemische Verbindungen (mehr
>> hier),
bei denen der vielseitige Kohlenstoff (siehe folgenden Kasten) eine
zentrale Rolle spielt. Die Frage nach dem Übergang von toter zu
lebendiger Materie ist allerdings eine der wichtigsten ungelösten
Fragen der Chemie, mehr dazu finden Sie >> hier.
Ein Mensch besteht aus mindestens 100.000 verschiedenen Molekülen;
und diese können ungeheuer komplex sein; ein durchschnittliches
Molekül der menschlichen Erbsubstanz DNS besteht aus 7,7 Milliarden
Atomen!
Kohlenstoff und Leben
Zwar besteht der menschliche Körper zu 60 Prozent aus Wasser und
darum hat Sauerstoff unter den Elementen den höchsten
Gewichtsanteil, aber zwei Drittel unseres Trockengewichts macht der
Kohlenstoff aus. Früher galt Kohlenstoff deshalb als Kennzeichen
des Lebens, der Begriff organische Chemie erinnert noch daran. Das
ist heute widerlegt. Aber auch im heutigen Verständnis, das Leben
den ganz "normalen" Gesetzen der Physik und der Chemie gehorcht
(siehe >> Was
ist Leben?), spielt Kohlenstoff eine zentrale Rolle
für die Chemie des Lebens. Das liegt daran, dass Kohlenstoff sich
mit vier anderen Elementen verbinden kann, chemisch also sehr
vielseitig und zudem reaktionsfreudig ist. So werden die
Polymerketten, die als Proteine, dem Erbmaterial DNS und Membranen
die Chemie des Lebens bestimmen, allesamt von einem
Kohlenstoffrückgrat durchzogen – vier Bindungsmöglichkeiten
bedeutet, dass ein Kohlenstoffatom sich mit zwei anderen zu einer
Kette zusammenhängender Atome verbinden kann und immer noch zwei
weitere Bindungsmöglichkeiten für andere Atome verbleiben. Als
Menschen essen wir jeden Tag 300 Gramm Kohlenstoff, und scheiden ihn
in Form von Kohlendioxid wieder aus.(In Science-Fiction-Bücher wird
gerne über Silizium-basiertes Leben in anderen Teilen des Weltalls
spekuliert. Der Hintergrund: auch Silizium kann vier chemische
Bindungen eingehen und Polymere (bekannt als Silikone) bilden. Auf
der Erde reagiert Silizium jedoch nicht so leicht wie Kohlenstoff;
unter anderen Bedingungen in anderen Regionen des Weltalls könnte
dies aber anders aussehen, und siliziumbasiertes Leben ist daher
nicht auszuschließen.)
Kohlenstoff spielt auf der Erde aber nicht nur in
Lebewesen eine zentrale Rolle, sondern er ist eines der wichtigsten
Elemente überhaupt (siehe >> Der
Kohlenstoffkreislauf). Dass seine Bindungen so energiereich
sind, macht die Reste fossiler Pflanzen und Tiere zu wertvollen fossilen Brennstoffen,
und das bei der Verbrennung freigesetzte Kohlendioxid zur
Hauptursache für den von Menschen verursachten Klimawandel).
Die Kunst der Verwandlung von Stoffen
Die Chemie beschäftigt sich aber nicht nur mit der Frage, woraus
die Dinge dieser Welt bestehen, sondern auch damit, wie sie
entstanden sind und was man aus den bekannten Stoffen noch alles
machen kann. Bei diesen Umwandlungen wird deutlich, dass die Chemie
aus der Alchimie hervorgegangen ist, jenem alten Zweig der
Naturkunde, dessen Anhänger unter anderem Blei in Gold verwandeln
wollten. Wie man heute weiß, muss man die Zahl der Protonen im Kern
ändern, um ein Element in ein anderes zu überführen; so etwas macht
aber die Physik (mehr >> hier),
nicht die Chemie. Mit den Methoden der Chemie bleiben die Atome
unverändert, können aber zu immer neuen Produkten zusammengestellt
werden - davon lebt die ganze chemische Industrie (mehr >>
hier). Der Weg hierzu sind chemische Reaktionen.
Die älteste vom Menschen gezielt genutzte chemische Reaktion ist
wohl die Gärung: Die Herstellung von Wein und Bier gehört zu den
ältesten Künsten der Menschheit; und nach mancher Ansicht liegt sie
sogar der Erfindung der Landwirtschaft zu Grunde (>>
hier). Hefezellen zerlegen dabei den Zucker aus Gerstenmaische
oder ausgepressten Weintrauben in Alkohol und Kohlendioxid. Eine
Gärung ist nur eine von vielen möglichen chemischen Reaktionen;
Chemiker unterscheiden vor allem Reaktionen, die Energie freisetzen
(exotherme Reaktionen) und solche, die Energie
verbrauchen (endotherme Reaktionen). Damit letztere
ablaufen, muss immer Energie zugeführt werden. Exotherme Reaktionen
können dagegen entweder spontan ablaufen, sobald die
Reaktionspartner zusammenkommen; oder es muss eine Aktivierungsenergie
aufgebracht werden, damit die Reaktion beginnt. Ein Beispiel ist die
Verbrennung von Benzin in einem Automotor: Die Reaktion ist exotherm
- das Auto fährt ja mit der freigesetzten Energie -, muss aber mit
einem Zündfunken aktiviert werden. Eine Verbrennung ist übrigens
chemisch eine Oxidation (mehr >> hier):
Kohlenstoff aus dem Benzin reagiert mit Sauerstoff aus der Luft. In
lebenden Zellen setzen Enzyme genannte Proteine
die Aktivierungsenergie herab und erleichtern und regeln damit die
chemischen Reaktionen des Stoffwechsels.
Neben den chemischen Reaktionen spielen die Zustandsveränderungen
der Stoffe eine wichtige Rolle in der Natur: Damit ist
gemeint, wenn feste Körper flüssig werden, Flüssigkeiten verdampfen
oder Dunst als Flüssigkeit niederschlägt, also schmelzen, verdampfen
und kondensieren (daneben gibt es noch das weniger bekannte
“sublimieren”, dies ist der Ausdruck dafür, dass ein fester Stoff
direkt verdampft, wie etwa das auf Kindergeburtstagen und bei
Rockkonzerten beliebte Trockeneis). Diese Zustandsveränderungen sind
aber eigentlich physikalische Vorgänge, sie werden durch Wärmezufuhr
beziehungsweise Wärmeentzug ausgelöst. So verdunstet Wasser, wenn es
durch die Sonne erwärmt wird, und kondensiert, wenn die aufsteigende
Luft abkühlt - eine wichtige Triebkraft des Wasserkreislaufs
(>>
hier).
Wie viel Energie für eine Zustandsveränderung notwendig ist bzw.
bei ihr freigesetzt wird, hängt von der Festigkeit der chemischen
Bindung ab: So verflüssigt (das durch Wasserstoffbrückenbindungen
gebundene) Wasser bei 0 Grad Celsius, das in Kristallen gebunden
Kochsalz erst bei 800 Grad Celsius und das in einem Metallbindung
gebundene Eisen schmilzt aber erst bei 1.500 Grad Celsius.
Webtipps:
Die vier Grundkräfte: Erklärung
auf solstice.de
Orbitalmodell:
quantenwelt.de
Hauptbeitrag:
Die
Entdeckung des Urknalls



 Protonen (oben) und Neutronen (unten)
sind aus Quarks zusammengesetzt. (Die Abbildung ist nicht
maßstäblich: Die Quarks umfassen nur ein Millionstel des Volumens
der Kernbausteine.) Eigene Abbildung.
Protonen (oben) und Neutronen (unten)
sind aus Quarks zusammengesetzt. (Die Abbildung ist nicht
maßstäblich: Die Quarks umfassen nur ein Millionstel des Volumens
der Kernbausteine.) Eigene Abbildung.  Eisenfeilspäne
auf Papier zeichnen die Richtung der Kraftlinien (heute: Feldlinien)
eines Magneten nach. Abb. aus Newton Henry Black, Harvey N. Davis
(1913) Practical Physics, The MacMillan Co., USA, p. 242, fig. 200.
Public domain.
Eisenfeilspäne
auf Papier zeichnen die Richtung der Kraftlinien (heute: Feldlinien)
eines Magneten nach. Abb. aus Newton Henry Black, Harvey N. Davis
(1913) Practical Physics, The MacMillan Co., USA, p. 242, fig. 200.
Public domain.